AISLAMIENTO, IDENTIFICACIÓN Y CARACTERIZACIÓN MOLECULAR DE BACTERIAS SIMBIÓTICAS FIJADORAS DE NITRÓGENO EN MEDICAGO SATIVA
ISOLATION, IDENTIFICATION AND MOLECULAR CHARACTERIZATION OF SYNTOTIC BACTERIA FIXING NITROGEN IN MEDICAGO SATIVA
Y. Bustamante Mamani1, N. Colque Apaza1, L. Hilary Cahuana1, Sh. Huancahuire Mamani1, k. Quenaya Escobar1, M. Sumire Pari1, C. Vasquez Choque1, Julio Cesar Bernabé Ortíz1
(1) Escuela Profesional de Biología,
Universidad Nacional de San Agustín, Arequipa - Perú
Resumen: En el presente trabajo se aisló, identificó y caracterizó molecularmente a bacterias simbióticas fijadoras de nitrógeno asociada a nódulos de Medicago sativa en el distrito de Socabaya, Arequipa. Para lo cual se extrajo nódulos de la raíz de Medicago sativa, a partir de esta muestra se sembró en medio agar nutritivo, se incubó por 3 días. Luego del crecimiento de colonias, se seleccionaron cepas de bacterias, en las cuales se realizó el aislamiento y 3 repiques por el método de estrías para una mejor purificación de la cepa.
A la cepa bacteriana se le denominó “socabaya01” al cual se le realizó un antibiograma con 5 tipos de antibióticos (Erytromicina, Amikacina, Norfloxacina, Ceftriaxona y amikacina), así mismo se realizó pruebas de tinción de Gram. Finalmente, todas estas cepas se mandaron a secuenciar al Instituto de Biotecnología del ADN Uchumayo. Una vez obtenida la secuencia de ADN se realizó el árbol filogenético de la cepa bacteriana “socabaya01” en el programa BLAST, el cual presentó un 99.79% de similitud con Bacillus toyonensis. Además de ser el primer registro como bacteria endófita al encontrase en los nódulos de Medicago sativa.
PALABRAS CLAVE: Nódulos, Medicago sativa, “SOCABAYA 01”, BLAST, Antibiograma, Tinción Gram
Abstract: In the present work molecular symbiotic fixing bacteria associated with Medicago sativa nodules in the district of Socabaya, Arequipa, were isolated, identified and molecularly characterized. For which nodules were extracted from the root of Medicago sativa, from this sample was seeded in nutritious agar medium, incubated for 3 days. After the growth of colonies, strains of bacteria were selected, in which the isolation was made and 3 repeals by the striae method for a better purification of the strain.
The bacterial strain was called " socabaya01", which was given an antibiogram with 5 types of antibiotics (Erythromycin, Amikacin, Norfloxacin, Ceftriaxone and amikacin), as well as Gram stain tests. Finally all these strains were sent to sequence to the Uchumayo DNA Biotechnology Institute. Once the DNA sequence was obtained, the phylogenetic tree of the bacterial strain "socabaya01" was performed in the BLAST program, which presented a 99.79% similarity with Bacillus toyonensis. In addition to being the first record as an endophytic bacteria found in Medicago sativa nodules.
KEY WORDS: Nodules, Medicago sativa, " socabaya01", BLAST, Antibiogram, Gram stain
INTRODUCCIÓN
Las leguminosas como la alfalfa, frijol, lenteja y garbanzo juegan un papel fundamental en la rotación de los cultivos gracias al proceso de fijación biológica de nitrógeno atmosférico. Estos cultivos poseen un papel fundamental en la agricultura moderna, ya que pueden contribuir de manera significativa a la disminución del consumo de energía fósil y la emisión de gases de efecto invernadero ocasionados por el uso de fertilizantes nitrogenados que originan gran parte de las emisiones de CO2 y N2O (Sall et al., 2015). La interacción de estas leguminosas con bacterias capaces de aprovechar una gran proporción del nitrógeno atmosférico (Familia Rhizobiaceae) resulta de gran importancia para el desarrollo de los cultivos (Assefa et al., 2013). La salinidad es uno de los principales problemas en los ecosistemas agrícolas en el mundo; cerca del 50 % del planeta está afectado por este flagelo (Ludwing,et al. , 2004 y Bui et al., 2013). Esto produce numerosos daños en el rendimiento de los cultivos, por otro lado, perjudica fisiológica y bioquímicamente a las plantas. De hecho, las comunidades microbianas, entre ellas las bacterias rizobios, disminuyen en número, diversidad y actividad, cuando los suelos dejan de cultivarse (Junior et al., 2004 y, Miao et al., 2015). Ante toda esta situación, una opción natural y ecológica para disminuir el efecto nocivo de las sales, y para mantener la producción bajo estrés salino, puede ser la selección e introducción de plantas o microorganismos adaptados a estas condiciones (Nour et al., 1994).
Los géneros Sinorhizobium, Rizobium, Bradyrhizobium, Mesorhizobium, Sinorhizobium y Azorhizobium de la familia rhizobiacea son simbióticos fijadores de nitrógeno que pueden encontrarse en las raíces de las plantas, principalmente las leguminosas. Estos microorganismos son los responsables de la porción más grande del nitrógeno fijado en el mundo (los microorganismos aportan 65% del nitrógeno disponible en la biósfera) (Ludwing et al., 2004). El estudio de la familia rhizobiacea, así como el de otras familias que contribuyen de manera significativa a la productividad de los cultivos agrícolas ha resultado ser un factor clave para la obtención de herramientas biotecnológicas que ayuden a enfrentar los retos de la agricultura moderna. Este estudio se llevó a cabo con el objetivo de aislar, identificar y caracterizar molecular de bacterias fijadoras de nitrógeno en Medicago sativa.
METODOLOGÍA
1. Toma de la muestra
Se realizó la recolección de muestras en cultivos de alfalfa, se tomó cinco plantas desde la raíz evitando la pérdida de los nódulos, el lugar de estudio fue el distrito de Socabaya de la ciudad de Arequipa, Perú, con coordenadas 16º 45’25,68’’S y 71º 53’ 96,90’’W; la muestra se almacenó en bolsas de plásticos estériles y estas fueron puestas en un recipiente de tecnopor para ser trasladados inmediatamente al laboratorio de microbiología de la escuela profesional de Biología-UNSA; y posteriormente se extrajo los nódulos de las raíces de la planta para continuar su sembrado en un medio de agar nutritivo.
2. Aislamiento
Se preparó el medio de cultivo pesando 2,8 g. de medio agar nutritivo, el cual fue provisto por el laboratorio del INSTITUTO DE BIOTECNOLOGIA DEL ADN UCHUMAYO. Después del pesado del agar, este se agregó a un vaso de precipitado con 100 mL de agua destilada, se disolvió y se cubrió con papel Craft para finalmente ser llevado a calentar hasta obtener un medio translúcido. Se dejó que el medio se enfríe y procedió a ser trasvasado a 4 placas Petri estériles con la ayuda de un mechero para evitar la contaminación del medio, finalmente se esperó su solidificación para su próximo uso. La muestra tomada se cultivó en el medio Agar nutritivo preparado usando la técnica de siembra por extensión con el objeto de asegurar el mayor crecimiento de bacterias nitrificantes presentes en los nódulos de la raíz de la alfalfa. Se esperó tres días para el correcto crecimiento de las colonias. Luego del crecimiento de colonias, se seleccionaron dos cepas de bacterias, en las cuales se realizó posteriormente el aislamiento en el cual se realizaron 3 repiques por el método de estrías. El período de repiques se realizó en alrededor de dos semanas.
3. Prueba de Tinción GRAM
Para revelar la forma de la bacteria, agrupación y grupo taxonómico al que pertenece, se realizó la identificación con tinción Gram a la cepa bacteria que había proliferado más. Para ello, se higienizó una lámina portaobjetos con alcohol y papel toalla, se colocó ¼ de una gota de agua destilada y se insertó el asa de Kohle, la cual previamente fue esterilizada y fue usada para tomar una muestra del cultivo puro, se extendió la muestra en la placa y se dejó secar durante 5 minutos. Luego, se cubrió la lámina con 1 gota de Cristal Violeta, se esperó 30 segundos y se procedió a su lavado con agua, inmediatamente se cubrió con 1 gota de Lugol, se esperó 30 segundos y se procedió a su lavado con 1 gota de Acetona y luego con agua, finalmente se cubrió la placa con 1 gota de Safranina, se esperó 30 segundos y se procedió a su lavado con agua. Para su posterior observación en el microscopio, se cubrió la lámina con aceite de inmersión y se procedió a observar a través del microscopio con un aumento de x100, teniendo como resultado que la cepa presenta una coloración roja característica de una bacteria gram-negativa.
4. Almacenamiento y preservación de las cepas
Una vez obtenido el cultivo, este se almacenó en una incubadora a 30°C, en un medio en donde pueda crecer óptimo, además este fue preservado sellando primero con cinta Fil y luego tapando y sellándolo con papel Craft.
5. Prueba de Susceptibilidad a Antibióticos
Para la Prueba de Susceptibilidad a Antibióticos se preparó 2 placas con agar nutritivo, Se pusieron 5 discos con diferentes antibióticos (Ceftriaxona, Erytromicina, Norfloxacina, Cloranfenical y Amikacina) por placa para poder clasificar la sensibilidad o resistencia de estas bacterias frente a estos antibióticos según el tamaño de halo de inhibición. Tomando como referencia, sensibilidad mayor de 15mm, intermedio 10-15mm y resistente menor de 10mm.
6. Extracción de ADN
Se extrajo 300 ul de buffer en tubos eppendorf, en estas se colocaron colonias (4-8), se agitó, se llevó a baño a maría por 30 min a 60 °C , se agitó, y centrifugó a 12000 rpm x 10´ se extrajo el sobrenadante (250 ul), se añadió alcohol isoamílico (300 ul) y centrifugó a 12000 rpm x 10´, añadir alcohol isopropanol a 0,5 volúmenes, y centrifugó a 12000 rpm x 10´ , obteniendo la formación de tres fases extrayendo la superficial y centrifugó a 12000 rpm x 10´. Finalmente, se resuspende en agua mili-q.
7. Identificación Molecular
Aislamiento de ADN y amplificación del gen DNAr 16S para bacterias.
Para la amplificación del gen ADNr16S se utilizaron las secuencias 5’ AGAGTTTGATCATGGCTCAG 3’ (Forward) y 5’ GTTACCTTGTTACGACTT 3’ (Reverse). En la amplificación del gen ADNr 16S se utilizaron los iniciadores universales FGPL 132`-38 y FGPS 6-63 que amplifican además los IGS (Nour y col., 1994); La amplificación se llevó a cabo en un volumen de 50 µl que contenía: Buffer 1X, 2 mM MgCl2, 50 µM dNTPs, 0.8 pmol de iniciador FGPL 132`-38 y 0.8 pmol de iniciador FGPS 6-63, 2.5U de Taq DNA Polimerasa recombinante de la marca InvitrogenTM ; el volumen de ADN se ajustó para alcanzar una concentración de 100 ng (Junior y col., 2004). La reacción de amplificación (PCR) se llevó a cabo en un termociclador Px2 Thermal Cycler® con un paso inicial de desnaturalización de 94ºC por 5 min; 35 ciclos con un programa de temperatura que consiste en: desnaturalización a 94ºC por 1 min, alineamiento a 54ºC por 1 min y elongación a 72ºC por 1 min; y un paso final de extensión de 72ºC por 5 min (Quatrini y col., 2001).
Secuenciación de productos de PCR.
La secuenciación es el procedimiento utilizado para determinar la secuencia de nucleótidos de una cadena de ADN purificado. Actualmente se utiliza el método de secuenciación automática basado en el método enzimático concebido por Frederick Sanger en 1977. Se realiza en aparatos automatizados especiales denominados secuenciadores (Sladrigas y col., 2005)
Filogenia molecular.
Para la filogenia molecular se utilizó la secuenciación junto con programas bioinformáticos.
RESULTADOS Y DISCUSIÓN
Aislamiento
Se logró aislar la cepa en el medio agar nutritivo en placas diferentes. El aislamiento de dichos microorganismos de la muestra indica la aparición de la cepa de bacteria denominada “SOCABAYA01”
Fig. 1 Resultado del primer repique de la cep“SOCABAYA01”
Prueba de tinción GRAM
Se realizó la caracterización microscópica por medio de la tinción gram, la cual indicó que la cepa “SOCABAYA01”, es un bacilo gram positivo
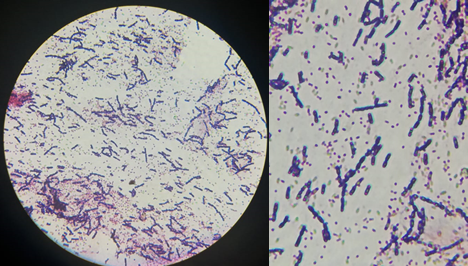
Fig. 2 Vista a través del microscopio de la cepa “Socabaya01”
Prueba de Sensibilidad a Antibióticos
Para la prueba de difusión de disco, después de 48 horas se observa una mayor resistencia a Erytromicina, Ceftriaxona y Amikacina, esto debido a que el diámetro del halo que se formó alrededor de estos antibióticos es menor en comparación a los otros.
El menor diámetro del halo nos indica que la bacteria presenta una mayor resistencia al efecto que produce sobre ella el antibiótico y los mayores diámetros nos permiten identificar los antibióticos más efectivos contra la bacteria de estudio.
También observamos que el mayor diámetro de halo se da en cloranfenicol por lo que podemos deducir que la bacteria es sensible a dicho antibiótico.
Tabla 1: Zona de inhibición (mm) para antibióticos transcurrido 48 horas.
|
Antibiótico |
Zona de inhibición (mm) 48 horas |
|
Bacteria “Socabaya01” |
|
|
Ceftriaxona |
11 |
|
Amikacina |
13 |
|
Norfloxacina |
18 |
|
Clorafenicol |
21 |
|
Erytromicina |
3 |
Secuenciación
A continuación, se muestra el árbol filogenético de la cepa bacteriana aislada denominada “Socabaya01”.
La muestra marcada en amarillo, presenta un 99.79% de similitud con Bacillus toyonensis strain Z3 16S

Fig. 3 Árbol filogenético construido en base al gen 16S rARN obtenido de la secuencia de la bacteria denominada “Socabaya01”
Registro en GenBank
La bacteria identificada como Bacillus sp. (Inicialmente denominada “Socabaya01”) corresponde a una nueva especie, por tanto, fueron registradas en GenBank.
Una vez enviados los documentos necesarios, se recibió el código de registro para Bacillus sp.
LOCUS Socabaya01 953 bp DNA linear 10-JUL-2019
DEFINITION Bacillus sp. strain Socabaya-01.
ACCESSION
VERSION
KEYWORDS .
SOURCE Bacillus sp.
ORGANISM Bacillus sp.
Unclassified.
REFERENCE 1 (bases 1 to 953)
AUTHORS Vasquez,C., Quenaya,K., Huancahuire,S., Hilary,L., Sumire,M.,
Bustamante,F., Ccolque,N. and Bernabe,J.
TITLE AISLAMIENTO, IDENTIFICACION Y CARACTERIZACION MOLECULAR DE
BACTERIAS SIMBIOTICAS FIJADORAS DE NITROGENO EN MEDICAGO SATIVA
JOURNAL Unpublished
REFERENCE 2 (bases 1 to 953)
AUTHORS Vasquez,C., Quenaya,K., Huancahuire,S., Hilary,L., Sumire,M.,
Bustamante,F., Ccolque,N. and Bernabe,J.
TITLE Direct Submission
JOURNAL Submitted (10-JUL-2019) Microbiologia General, Universidad Nacional
de San Agustin, Av. Alcides Carrion s/n J.L.B y Rivero, Peru,
Arequipa, Arequipa, Peru
COMMENT ##Assembly-Data-START##
Sequencing Technology :: Sanger dideoxy sequencing
##Assembly-Data-END##
FEATURES Location/Qualifiers
source 1..953
/organism="Bacillus sp."
/mol_type="genomic DNA"
/strain="Socabaya-01"
/isolation_source="Nitrogen fixer"
/note="[cultured; wizard]"
rRNA <1..>953
/product="16S ribosomal RNA"
BASE COUNT 249 a 207 c 301 g 194 t 2 others
ORIGIN
1 cagtcgagcg aatggattga gagcttgctc tcatgaagtt agcggcggac gggtgagtaa
61 cacgtgggta acctgcccat aagactggga taactccggg aaaccggggc taataccgga
121 taatattttg aactgcatgg ttcgaaattg aaaggcggct tcggctgtca cttatggatg
181 gacccgcgtc gcattagcta gttggtgagg taacggctca ccaaggcaac gatgcgtagc
241 cgacctgaga gggtgatcgg ccacactggg actgagacac ggcccagact cctacgggag
301 gcagcagtag ggaatcttcc gcaatggacg aaagtctgac ggagcaacgc cgcgtgagtg
361 atgaaggctt tcgggtcgta aaactctgtt gttagggaag aacaagtgct agttgaataa
421 gctggcacct tgacggtacc taaccagaaa gccacggcta actacgtgcc agcagccgcg
481 gtaatacgta ggtggcaagc gttatccgga attattgggc gtaaagcgcg cgcaggtggt
541 ttcttaagtc tgatgtgaaa gcccacggct caaccgtgga gggtcattgg aaactgggag
601 acttgagtgc agaagaggaa agtggaattc catgtgtagc ggtgaaatgc gtagagatat
661 ggaggaacac cagtggcgaa ggcgactttc tggtctgtaa ctgacactga ggcgcgaaag
721 cgtggggagc aaacaggatt agataccctg gtagtccacg ccgtanacga tgagtgctaa
781 gtgttagagg gtttccgccc tttagtgctg aagttaacgc attaagcact ccgcctgggg
841 agtacggccg caaggctgaa actcnaagga attgacgggg gcccgcacaa gcggtggagc
901 atgtggttta attcgaagca acgcgaagaa ccttaccagg tcttgacatc ctc
//
Posibles Aplicaciones de la Bacteria Bacillus sp.
Esta parte se derivó del árbol filogenético de la bacteria, tomando en cuenta cualidades de bacterias que tienen similitud de un 99%, a las cuales podemos llamar parientes de la bacteria recién tratada.
Bacillus es un género de interés, dado que aporta un amplio perfil de diversidad fisiológica (acidofilia, alcalofilia, psicrofilia, termofilia y parasitismo), virtud que es otorgada por la formación de su espora, cualidad que le permite estar en diferentes hábitats tanto acuáticos como terrestres. (Corrales, et al. 2016)
Se ha podido observar que el género Bacillus spp. es un agente biofertilizante que ha sido estudiado en las últimas 5 décadas con un crecimiento significativo, relacionado con las actividades físico-químicas de las enzimas nitrogenadas y fosforiladas que contribuyen a la promoción de crecimiento vegetal. (Corrales, et al. 2016)
CONCLUSIONES
Se logró un correcto aislamiento, identificación y caracterización molecular de las bacterias nitrificantes socabaya01 presente en nódulos de Medicago sativa (alfalfa) y presentan similitud con Bacillus toyonensis. Socabaya01 se encuentra representado por el nodo azul en la ilustración del árbol filogenético.
REFERENCIAS
[1] Ludwing, F.; Dawson, T. E.; Prins, H. H. T.; Berendse, F. and de Kroon, H. (2004). Below-ground competition between trees and grasses may overwhelm the facilitative effects of hydraulic lift. Ecol Lett. 7:623-631
[2] Bui EN. Soil salinity: A neglected factor in plant ecology and biogeography. Journal of Arid Environments. (2013); 92 (Supplement C):14–25. doi:10.1016/j.jaridenv.2012.12.014Setia R, Gottschalk P, Smith P, Marschner P, Baldock J, Setia D, et al. Soil salinity decreases global soil organic carbon stocks. Science of The Total Environment. 2013;465:267–72. doi:10.1016/j.scitotenv.2012.08.028
[3] Junior, F., Silva, M., Teixeira, K., Urquiaga, S. y Reis, M. (2004). Identification of Azospirillum amazonense isolates associated to Brachiaria spp. at different strategies and growth conditions and bacterial plant hormone production. Revista Brasileira de Ciéncias Sociais 28: 103- 113
[4] Miao Y, Liao R, Zhang X-X, Liu B, Li Y, Wu B.(2015) Metagenomic insights into salinity effect on diversity and abundance of denitrifying bacteria and genes in an expanded granular sludge bed reactor treating high-nitrate wastewater. Chemical Engineering Journal;277(Supplement C): 116–23. doi:10.1016/j.cej.2015.04.125
[5] Nour, SM., Cleyet-Marel, JC., Beck, D., Effosse, A. y Fernandez, MP. (1994). Genotypic and phenotypic diversity of Rhizobium isolated from chickpea (Cicer arietinum L.). Can. J Microbiol. 40: 345-354
[6] Sall SN, Ndour NYB, Diédhiou-Sall S, Dick R, Chotte J-L.(2015). Microbial response to salinity stress in a tropical sandy soil amended with native shrub residues or inorganic fertilizer. Journal of Environmental Management.; 161:30–7. doi:10.1016/j.jenvman.2015.06.017
[7] Assefa T, Beebe SE, Rao IM, Cuasquer JB, Duque MC, Rivera M. (2013)Pod harvest index as a selection criterion to improve drought resistance in white pea bean. Field Crops Research.148(Supplement C):24–33. doi:10.1016/j.fcr.2013.04.008
[8] Rispaila, N.; Kalo, P.; Kissb, G. B.; Ellisc, N. T. H.; Gallardod, K.; Richard, D.; Thompsond, Pratsa, E.; Larrainzare, E.; Ladrerae, R.; González, E. M.; Arrese- Igore, C.; Fergusong, B.; J.; Gresshoffg, P. M. and Rubiales, D. (2010). Model legumes contribute to faba bean breeding. Field Crop Res. 253-262.
[9] Saldrigas, V., Claros, G., y Gonzales, D.,(2005).vocabulario ingles- español de bioquímica y biología molecular. Panace 6(19)
[10] Quatrini, P., Scaglione, G., Cardinale, M., Caradonna, F. y Puglia, AM. (2001). Bradyrhizobium sp. nodulating the Mediterranean shrub Spanish broom (Spartium junceum L.) J Appl. Microbiol. 92: 13- 21
[11] FAO (Food and Agriculture Organization of the United Nations). (1984). Legume inoculants and their use. Rome, Italy: FAO. 1-32 pp.
[12] Corrales, L.; Caycedo,L.; Gómez, M.; Ramos, S.; Rodríguez, J. (2016). Bacillus spp: una alternativa para la promoción vegetal por dos caminos enzimáticos.
...Revista Seleccionada
Enero 2019 Volumen 5 - Número 1 P 65-68
DOI: 10.26696/sci.epg.0095
Enlaces
CIENCIAS SOCIALES Y HUMANIDADES
CIENCIAS BIOLÓGICAS Y DE SALUD


