AISLAMIENTO, IDENTIFICACIÓN Y CARACTERIZACIÓN MOLECULAR DE MICROORGANISMOS AISLADOS DE AGUAS DEL RÍO TAMBO
ISOLATION, IDENTIFICATION AND MOLECULAR CHARACTERIZATION OF MICROORGANISMS ISOLATED FROM TAMBO RIVER
M. Nuñez Mamani1, L. Polanco Vera1, A. Vera Arias1, Julio César Bernabé Ortiz2
(1) Escuela Profesional de Ingeniería Ambiental, Universidad Nacional de San Agustín, Arequipa – Perú, Principales.
(2) Escuela Profesional de Biología, Universidad Nacional de San Agustín,
Arequia - Perú.
RESUMEN: Las aguas provenientes del río Tambo están cercanas al próximo mega-proyecto minero “Tía María”. En el presente trabajo de investigación se aisló y caracterizó bacterias de este cuerpo de agua superficial con la intención de establecer un precedente de la microbiota del río. Para este propósito, se recolectó una muestra de agua superficial y a partir de ésta se sembró en medio Agar nutritivo y se incubó por 1 semana a temperatura ambiente. Se seleccionaron 2 cepas, se realizó 5 repiques para purificar cada una de éstas. Luego, se les realizó pruebas de tinción de Gram y pruebas de sensibilidad; finalmente todas estas cepas fueron secuenciadas, previa extracción de ADN. Las cepas aisladas pertenecen a los géneros Pseudomona sp. (1 cepa) y Jonesia sp. (1 cepa).
PALABRAS CLAVE: aislamiento, agua, bacteria, río, Tambo.
ABSTRACT: The water coming from Tambo river are close to the next mining mega-project “Tia Maria”. In this paper, bacterias were isolated and characterized from this superficial water body with the aim of establishing a precedent from microbiota of the river. For this purpose, a water sample was collected and from it was seeded in nutrient Agar medium and incubated for 1 week at room temperature. Two strains were selected and five replications were performed to purify each of them. Then, they were tested for Gram Staining and sensitivity tests; finally all these strains were sequenced, previous DNA extraction. The isolated strains belong to the genus Pseudomona sp. (1 strain) and Jonesia sp. (1 strain).
KEYWORDS: bacteria, isolation, river, Tambo, water.
INTRODUCCIÓN
El agua es uno de los factores más importantes que juegan un papel crucial en cualquier cambio en el ambiente al afectar flora y fauna de zonas cercanas y su contaminación puede crear gran daño a los humanos, así como al ambiente. La calidad del agua del río está muy influenciada por la industria, la agricultura y la gran cantidad de actividades humanas que afectan sus características físico-químicas y sus cualidades microbianas (Singh & Sao, 2015), como el cierre de los ciclos de los nutrientes (Kümmerer, 2004).
La microbiología del agua se ocupa de los microorganismos que viven en el agua o que se transportan de un hábitat a otro por el agua. El agua favorece el crecimiento de muchos tipos de microorganismos. (Singh & Sao, 2015). Las bacterias presentan una gran adaptación de climas, pH, temperatura, alimento, hasta incluso su resistencia a antibióticos ha sido reconocida como un problema a nivel mundial (Sayah et al., 2005).
Este trabajo consiste en establecer un precedente de las bacterias procedentes de la microbiota del río Tambo antes del próximo mega-proyecto minero “Tía María”. Se recolectó una muestra de agua superficial y a partir de esta se sembró en medio Agar nutritivo, se incubó por 1 semana a temperatura ambiente y con 5 repiques se logró aislar dos cepas.
Una vez hecha la caracterización e identificación, de las bacterias Pseudomona sp. y Jonesia sp. Se procedió a determinar los posibles usos ambientales de las mismas.
METODOLOGÍA
1. Recolección de la muestra
Se realizó la toma de muestra en el río Tambo, ciudad de Arequipa, Perú, (17°00'48.8"S 71°39'24.2"W); con el empleo de frascos estériles de 100 ml, a 20 cm de profundidad del río; las muestras se preservaron a 4°C de temperatura hasta el momento del desarrollo del análisis.
2. Aislamiento
Se preparó el medio de cultivo, pesando 2,8 g de medio Agar Nutritivo, se agregó a un vaso precipitado con 100 ml de agua destilada, se disolvió y cubrió con papel Craft para ser llevado a un horno a presión de 1 atm a la temperatura de 120°C durante 10 minutos. Se dejó enfriar luego se trasvasó a 4 placas estériles, frente a un mechero para evitar la contaminación del exterior y se esperó a su solidificación.
La muestra tomada se cultivó en el medio Agar nutritivo preparado, siguiendo el procedimiento establecido para la técnica de siembra por extensión con el fin de obtener el mayor crecimiento de una variedad de especies de bacterias pertenecientes al rio Tambo. Se esperó una semana para el crecimiento de colonias, debido a que una bacteria se reproduce cada 20 minutos aproximadamente.
Se seleccionaron dos cepas de bacterias (denominadas “BRT01” y “BRT02”) para su próxima identificación mediante un proceso de aislamiento, se realizaron 5 repiques de cada bacteria seleccionada mediante la técnica de siembra por estrías, este procedimiento se realizó durante 5 semanas.

Figura 01: procedimiento de repique
3. Obtención de cultivo puro
Se preparó la solución Tritón x100 (0,01 M) y se trasvasó a dos tubos Eppendorf, se tomó muestra del repique N°5 mediante el uso del asa de Kohle, previamente esterilizada y enfriada; luego se introdujo el asa de Kohle con muestra en el tubo Eppendorf y se mezcló. Se cerró el tubo Eppendorf y se procedió a agitar vigorosamente por 5 minutos, con el fin de obtener una mezcla homogénea. Con la ayuda de una micropipeta se tomó 50 µL de la mezcla homogénea para colocarla en una placa con Agar nutritivo; simultáneamente en un vaso precipitado con alcohol se encontraba el asa de Digralsky, la cual se esterilizó y enfrió, para expandir la muestra por toda la placa, se flameó la tapa de la placa, se tapó y se cubrió la placa con papel Craft para ser preservada.
4. Prueba de Tinción Gram
Se realizó para poder observar la forma de la bacteria y distinguir las bacterias Gram (+) y bacterias Gram (-). Para ello, se limpió un portaobjetos con alcohol y papel, se colocó cuidadosamente ¼ de gota de agua destilada en la lámina con la ayuda de la pizeta, se esterilizó y enfrió el asa de Kohle, con la cual se tomó muestra del cultivo puro, a continuación se sumergió el asa de Kohle con la muestra en la gota de agua destilada y se extendió (1cm x 1cm), se hizo secar la gota aproximadamente durante 30 minutos (Extendido). Después, se procedió a cubrir con Cristal Violeta (1 o 2 gotas) y se esperó 1 minuto para posteriormente lavarlo con agua, inmediatamente se cubrió con Lugol (1 o 2 gotas) y se esperó 1 minuto, en esta ocasión se lavó con Acetona (10 gotas) hasta limpiar la lámina, luego se lavó con agua, finalmente se cubrió con Safranina (1 o 2 gotas) y se esperó 1 minuto para lavar con agua potable. Se cubrió la lámina con aceite de inmersión y se procedió a observar las características morfológicas de las dos cepas seleccionadas (“BRT01” y “BRT02”) con un aumento x 100 del microscopio.
5. Almacenamiento y preservación
Una muestra de cada cepa fue preservada en medio de cultivo conteniendo glicerol al 20%, se agregó 0.5 ml. del medio de preservación en un tubo Eppendorf (uno por cada cepa) con la ayuda de una micropipeta. Posteriormente con un asa de Kohle se tomó una muestra de cada cepa pura y se sumergió en un tubo con glicerol. Finalmente los tubos fueron empaquetados y refrigerados para su preservación.
6. Prueba de susceptibilidad a antibióticos
Para realizar esta prueba se sembró por extensión las dos bacterias en una placa con medio Agar nutritivo cada una.
La prueba de sensibilidad a antibióticos se realizó mediante la prueba de difusión por disco. Se utilizaron los siguientes antibióticos: Cefadroxilo, Cefuroxima, Claritromicina, Cefalotina, Tetraciclina y Amikacina, distribuyendo los discos en la placa de manera uniforme similar a un reloj mediante el uso de unas pinzas. Posteriormente se incubaron las placas en un horno a 28°C. Se observaron los resultados 2 veces cada 24 horas.
7. Identificación molecular
7.1 Aislamiento de ADN y amplificación del gen RNAr 16S.
Se extrajo el ADN de las placas con cultivo puro de las dos cepas seleccionadas (denominadas “BRT01” y “BRT02”) obtenidas previamente, y se enviaron a Functional Biosciences, Inc. (USA) en donde fueron secuenciados siguiendo el método Sanger acoplado a Big Dye terminator v3.1 y corridos en un secuenciador ABI 3770xl. Las secuencias fueron revisadas y corregidas usando el software Sequencher v. 4.1 (Gene Codes).
Se obtuvieron los resultados de la secuenciación de las dos cepas seleccionadas.
7.2 Filogenia molecular
Las secuencias del gen RNAr 16S de las dos cepas seleccionadas se analizaron y compararon con las secuencias depositadas en la base de datos GenBank utilizando el algoritmo BLAST (blast) (www.ncbi.nlm.nih.gov/BLAST), para ello con la selección de 10 bacterias semejantes se construyeron los arboles filogenéticos, para de esta manera determinar las distancias genéticas así como el porcentaje de similitud con otras especies de bacterias.
RESULTADOS Y DISCUSIÓN
1. Aislamiento
Del proceso de aislamiento se pudo seleccionar dos cepas (denominadas “BRT01” y “BRT02”), las cuales tenían características morfológicas distintivas; la cepa denominada “BRT01” tenía un color marrón pálido, por otro parte la cepa denominada “BRT02”, era amarilla fuerte. En el primer repique se observa que la cepa “BRT01” muestra crecimiento normal, en la cepa “BRT02”, se observó crecimiento lento y contaminación. En el segundo repique, tercer repique y cuarto repique se observa crecimiento similar en ambas cepas, en las bacterias de la cepa “BRT02” se observa crecimiento retardado, se presume que esto se debe a condiciones externas a las que está sometida, se requieren más estudios para determinarlas estas causas. En el quinto repique se sometió a calor las bacterias de la cepa “BRT02”, a pesar del aumento de temperatura, la bacteria no mostró mayor crecimiento.

Figura 02: Cuarto repique de cepa “BRT01” (Izquierda) y cepa “BRT02” (Derecha).
2. Prueba de tinción Gram
Se realizó la caracterización microscópica de las dos cepas seleccionadas (denominadas “BRT01” y “BRT02”), por medio de la tinción Gram, obteniendo como resultado:

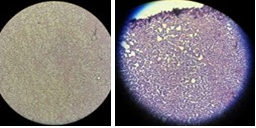
Figura 03: Prueba Gram de cepa “BRT01” (Izquierda) y cepa “BRT02” (Derecha).
3. Prueba de susceptibilidad a antibióticos
Los resultados de resultados de la prueba de susceptibilidad a antibióticos se muestran en la Tabla 1 y Figura 04; la cepa “BRT01” mostró resistencia a todos los antibióticos excepto a la Amikacina, la cual inhibió completamente su crecimiento. A pesar de que la cepa “BRT02” mostró ser más sensible a la Claritromicina que a los otros antibióticos, se observó que es resistente a la Amikacina.
Tabla 1. Diámetro inhibido de las bacterias por los antibióticos.

*(1) Cefadroxilo; (2) Cefuroxima, (3) Claritromicina; (4) Cefalotina; (5) Tetraciclina; (6) Amikacina

Figura 04: Prueba Gram de cepa “BRT01” (Izquierda) y cepa “BRT02” (Derecha).
4. Secuenciación
Los resultados de la comparación de las secuencias obtenidas de las dos bacterias seleccionadas, cepa “BRT01” y cepa “BRT02”, mostraron similitud con Pseudomona sp. y Jonesia sp, respectivamente. A continuación, se presentan los arboles filogenéticos de las bacterias.

Figura 05: Árbol filogenético construido en base al gen 16S rARN obtenido de la secuencia de la bacteria denominada “BRT01”.

Figura 06: Árbol filogenético construido en base al gen 16S rARN obtenido de la secuencia de la bacteria denominada “BRT02”.
5. Registro en GenBank
Ambas bacterias identificadas como Pseudomona daangensis (Inicialmente denominada “BRT01”) y Jonesia maliensis (Inicialmente denominada “BRT02”) correspondían a nuevas especies, razón por la cual fueron registrada en GenBank, base de datos de secuencias genéticas del NIH (National Institutes of Health, USA).
Posteriormente se recibieron los códigos de registro para Pseudomona daangensis (MH643732) y Jonesia maliensis (MH 643733).
6. Probables usos ambientales
En el análisis bibliográfico se recolectó información sobre los probables usos ambientales de Pseudomona sp. En el campo de la agricultura, Pseudomona sp degradó la antrazina en medio sólido, este es un herbicida utilizado nivel global para controlar malezas en cultivos de maiz, sorgo y caña de azucar, Pseudomona sp fue capaz de degradar el 99% de atrazina in vitro después de 24 h de incubación (Tonelli et al., 2018).
(Farag et al., 2018) demostraron que la Pseudomona sp. sp48 tiene una alta potencia para la degradación del aceite hasta el 1.5% y consumo de hidrocarburos aromáticos (fenol y naptaleno) y alifático (pentadecano) llegando a 79, 73, 62% respectivamente. En China encontraron una nueva bacteria que era capaz de eliminar el 46 % del azufre total del carbón de lignito pero sin alterar su poder calorífico eliminando solo el contenido de sus cenizas, después de evaluar la bacteria por medio de la identificación celular de gen 16S rRNA encontraron que esta bacteria era una Pseudomona sp designada como NP22 (Liu, Tong et al., 2017).
Pseudomona sp. puede degradar tintes sintéticos en las aguas residuales de textiles (Roy Uttariya et al., 2018) estudiaron la eliminación de un colorante téxtil (Amarillo reactivo) por medio de 3 degradantes (1) Pseudomonas sp, (2) Ceniza volante y (3) Pseudomonas sp inmovilizada sobre flyash; donde se encontro que el porcentaje de eliminación del colorante fue 92.62%, 88.51% y 98.72% respectivamente encontrando que Pseudomonas sp inmovilizada en flyash actuó como un mejor agente decolorante.
Un estudio en China reveló la propiedad de las bacterias que tienen biodegradabilidad con bisfenol A en agua de río e identificaron la diferencia de la degradación en condiciones aeróbicas y anaeróbicas, se encontró que la degradación es más rápida en condiciones aeróbicas que anaeróbicas, las dos cepas que tenían una alta biodegradabilidad se identificaron como Pseudomona sp. y Pseudomonas putida (J.-H. Kang and F. Kondo, 2002). En aguas de pozo, aguas de río y agua corriente las Pseudomonas degradaron los ésteres de ftalato (PE), especialmente el ftalato de di-n-butilo (DBP) y el ftalato de di- (2-etilhexilo) (DEHP). En pruebas de degradación de PE, el agua del río Tempaku degradaba casi el 100% de ftalato de dietilo (DEP), di-isobutil ftalato y DBP, y aproximadamente 70% de DEHP gracias a estas Pseudomonas demostrando tambien esta propiedad de biodegradación particular de ellas (Hashizume, K et al ., 2002).
Las pseudomonas también pueden sobrevivir en el agua marina como lo indicó (Thomas D. Leser et al., 1995) evaluando la supervivencia de la Pseudomona sp. B13 (FR1) en microscosmos marinos determinando que la Pseudomonas sp. La cepa B13 (FR1) en los microcosmos parece afectar solo a la comunidad de bacterioplancton indígena transitoriamente.
Estos estudios han revelado la importancia de las Pseudomonas sp en la degradación de herbicidas (antrazina), aceites e hidrocarburos aromáticos (fenol y naptaleno), alifáticos (pentadecano), colorantes sintéticos en aguas residuales textiles (Amarillo radioactivo), polímeros (recubrimiento de aluminio/epoxi), sustancias ligadas a carcinogenicidad, la teratogenicidad y la alteración endocrina (Farato de dibutilo), cultivos contaminados con HAPs y lodos de aguas residuales(fenantreno), ésteres de aguas de pozos, río y corrientes (PE, DBP, DEHP). Cabe mencionar que este tipo de bacterias persisten tanto en agua marina como agua dulce.
En el análisis bibliográfico se recolectó información sobre los probables usos ambientales de Jonesia sp. En el campo de la agricultura, la bacteria Jonesia tiene propiedades degradadoras, (M. Shehzadi et al , 2015) hicieron un estudio sobre 3 plantas degradadoras Typha domingensis, Pistia stratiotes y Eichhornia crassipes donde estas plantas contienen varias bacterias endofíticas entre ellas la Jonesia sp. EISII3 demostrando la capacidad degradadora de esta bacteria.
Las xilanasas extracelulares son enzimas que retienen iones metálicos y podría considerarse como un biocatalizador termotolerante, el cual es de interés para aplicaciones biotecnológicas, esta enzima fue producida a partir de Jonesia denitrificans BN-13 en un estudio realizado por (Nawel et al., 2011). El género Jonesia también sirve para clonar, un nuevo gen de endoglucanasa (JqCel5A) se clonó a partir de Jonesia quinghaiensis y se expresó funcionalmente en Escherichia coli Rosetta (DE3) (Lin et al., 2016).
CONCLUSIONES
Se aisló, caracterizó y secuenció las bacterias presentes del género Pseudomona daangensis y Jonesia maliensis procedentes de las aguas del río Tambo.
REFERENCIAS
[1] Cespedes, L., Nahat, R., Mendonca, T., Tavares, R., Oliveira-Filho, E., Silva, L., Taciro, R., Sánchez, R., Gómez, J. (2018). A non-naturally-occurring P(3HB-co-3HAMCL) is produced by recombinant Pseudomonas sp. from an unrelated carbon source. International Journal of Biological Macromolecules, 512-519.
[2] Dunlap, A. (2019). ‘Agro sí, mina NO!’ the Tía Maria copper mine, state terrorism and social war by every means in the Tambo Valley, Peru. Centre for Development and the Environment at the University of Oslo, Norway.
[3] Farag, S., Soliman, N., Abdell-Fattah. (2018). Statistical optimization of crude oil bio-degradation by a local marine bacterium isolates Pseudomonas sp. sp48. Journal of Genetic Engineering and Biotechnology.
[4] Hashizume, K., Nanya, J., Toda, C., Yasui,T., Nagano, H., Kojima, N. (2002). Phthalate Esters Detected in Various Water Samples and Biodegradation of the Phthalates by Microbes Isolated from River Water . Biol. Pharm. Bull, 209-214.
[5] J.-H. Kang and F. Kondo. (2002). Bisphenol A Degradation by Bacteria Isolated from River Water. Arch. Environ. Contam. Toxicol, 265–269.
[6] K. Kümmerer, Resistance in the environment, Journal of Antimicrobial Chemotherapy, Volume 54, Issue 2, August 2004, Pages 311–320.
[7] Liu, Tong., Hou, Jin-Hui., Peng, Yao-li. (2017). Effect of newly isolated native bacteria, Pseudomonas sp. NP22 on desulfurization of the low-rank lignite. International Journal of Mineral Processing, 6-11.
[8] Raida S. Sayah, John B. Kaneene, Yvette Johnson, RoseAnn Miller (2005). Patterns of Antimicrobial Resistance Observed in Escherichia coli Isolates Obtained from Domestic- and Wild-Animal Fecal Samples, Human Septage, and Surface Water Applied and Environmental Microbiology, 71 (3) 1394-1404.
[9] Roy, U., Sengupta, S., Banerjee, P., Das, P., Bhowal, A., Datta, S. (2018). Assessment on the decolourization of textile dye (Reactive Yellow) using Pseudomonas sp. immobilized on fly ash: Response surface methodology optimization and toxicity evaluation. Journal of Environmental Management, 185-195.
[10] Singh, R., & Sao, S. (2015). Isolation and Identification of Bacteria from Hasdeo River Water in Champa Region and Level of Microbial Pollution. International Journal of Research Studies in Biosciences (IJRSB)
[11] Sun, K., Habteselassie, MY., Liu, J., Li, S., Gao, Y. (2018). Subcellular distribution and biotransformation of phenanthrene in pakchoi after inoculation with endophytic Pseudomonas sp. as probed using HRMS coupled with isotope-labeling. Environmental Pollution, 858-867.
[12] Thomas D. Leser., Mette Boye., and Niels B. Hendriksen. (1995). Survival and Activity of Pseudomonas sp. Strain B13(FR1) in a Marine Microcosm Determined by Quantitative PCR and an rRNA-Targeting Probe and Its Effect on the Indigenous Bacterioplankton. APPLIED AND ENVIRONMENTAL MICROBIOLOGY, 1201–1207.
[13] Tonelli, A., Santos, V., Bauermeister, A., Rizzato, J., Peporine, N., Guedes, E. (2018). Degradation of atrazine by Pseudomonas sp. and Achromobacter sp. isolated from Brazilian agricultural soil. International Biodeterioration & Biodegradation, 17-22.
[14] Lin, L., Liu, X., Zhou, Y., Guan, L., He, J., Huang, W. (2016). A novel pH-stable, endoglucanase (JqCel5A) isolated from a salt-lake microorganism, Jonesia quinghaiensis. Electronic Journal of Biotechnology, 56-62.
[15] M. Shehzadi, K. Fatima, A. Imran, M. S. Mirza, Q. M. Khan & M. Afzal. (2015). Ecology of bacterial endophytes associated with wetland plants growing in textile effluent for pollutant-degradation and plant growth-promotion potentials. Official Journal of the Societa Botanica Italiana, 37-41.
...
Revista Seleccionada
Enero 2019 Volumen 5 - Número 1 P 53-57
DOI: 10.26696/sci.epg.0093
Enlaces
CIENCIAS SOCIALES Y HUMANIDADES
CIENCIAS BIOLÓGICAS Y DE SALUD


